ヒスタミンに関する研究
ヒスタミン合成
ヒスタミンはヒスチジンを特異的基質とするヒスチジン脱炭酸酵素(L-Histidine decarboxylase, HDC)により生合成されます。HDCを発現する細胞は限定されていますが、その産生パターンに基づき二つに分類することができます。一つは、顆粒をもつ細胞によるもので、産生されたヒスタミンは直ちに顆粒内へと取り込まれます。これはさらに顆粒内のヒスタミンを刺激に応じて放出する細胞(マスト細胞、好塩基球、ニューロン)と、比較的早い回転で連続して放出する細胞(活性化好中球、ECL (enterochromaffin-like)細胞)に分類できます。もう一つは、顆粒をもたない細胞によるもので、産生されたヒスタミンは形質膜のトランスポーターを介して直ちに細胞外へと放出されます。このカテゴリーには活性化したマクロファージや樹状細胞が含まれます。ヒスタミン産生細胞には常にヒスタミンを産生する細胞と、通常はヒスタミンを合成しないが刺激に応じて産生する細胞があります。前者にはマスト細胞、好塩基球、ECL細胞、ニューロンが、後者としてはマクロファージ、樹状細胞、好中球があげられます。
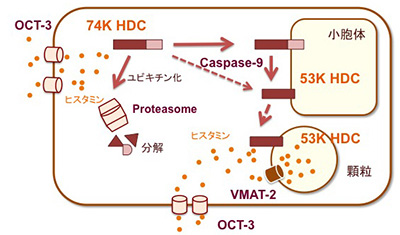
HDCは74-kDaの前駆体として合成された後、翻訳後プロセシングを受け53-kDaの成熟体へと変換されます(Tanaka, S. et al., J. Biol. Chem., 1998)。前駆体は不安定で、ユビキチン化されプロテアソームにより分解されます(Tanaka, S. et al., FEBS Lett. 1997)。翻訳後プロセシングに関わる酵素は不明ですが、私たちはマウスマスト細胞株ではカスパーゼ9が関与することを明らかにしています(Furuta, K. et al., J. Biol. Chem., 2007)。成熟体の53-kDa分子種は、マスト細胞、好中球(Tanaka, S. et al. Eur. J. Immunol., 2004)でいずれも顆粒に分布しますが、移行の機序の詳細は不明です。図は細胞内のヒスタミン合成を模式的に示したものです。細胞種による相違はありますが、サイトゾルで産生されたヒスタミンは、VMAT-2をはじめとするアミントランスポーターにより顆粒に取り込まれるか、あるいは形質膜に分布するカチオントランスポーターにより細胞外へと放出されると考えられています(Erickson, J.D. et al., Proc. Natl. Acad. Sci. USA, 1996, Schneider, E. et al., J. Exp. Med., 2005)。
炎症反応
ヒスタミンの機能のうちもっともよく知られたものの一つは、炎症を惹起する機能です。即時型アレルギーではマスト細胞から放出されたヒスタミンが近傍のH1受容体に作用して、種々のアレルギー症状が惹起されます。血管内皮細胞は重要な標的の一つであり、H1受容体の活性化により血管透過性の亢進、一酸化窒素(NO)の合成、接着分子の活性化が亢進することが知られています。炎症の主徴である、発赤(赤み)、腫脹(腫れ)はいずれもヒスタミンの作用に負うところが大きいです。このことから、H1受容体拮抗薬は即時型アレルギー疾患における重要な治療薬として位置づけられます。私たちはこれまでに高濃度のIgEがマスト細胞のヒスタミン合成を誘導すること、およびマスト細胞の顆粒の成熟過程にはヒスタミンが必要であることを明らかにしています(Tanaka, S. et al., J. Exp. Med., 2002, Nakazawa, S. et al., Eur. J. Immunol., 2013)。このような応答は、高IgE血症を伴うアレルギー性疾患の増悪におけるマスト細胞の関与を示すものかもしれません。
サイトカイン産生の制御
ヒスタミン受容体は現在、H1-H4の4種類が報告されていますが、その発現細胞にはそれぞれ特徴があります。免疫系においてはH3を除く3種類のヒスタミン受容体の発現が報告されており、それぞれ、サイトカイン産生の制御に関わることが報告されています。
- H1受容体:H1受容体は自己免疫疾患の関連遺伝子の一つとして報告されています。Th1細胞に発現する主要なヒスタミン受容体であり、Th1応答(IFN-γ産生)を増強することが明らかとなっています。
- H2受容体:骨髄球系細胞によるサイトカイン産生(TNF-α等)を抑制することや、Th2細胞によるサイトカイン産生をそれぞれ抑制することが報告されています。
- H4受容体:NKT細胞によるサイトカイン産生を増強することが報告されています。
腫瘍免疫とヒスタミン
H2受容体アンタゴニストが一部のがんに対して抗腫瘍効果を示すことは臨床において報告されていますが、そのメカニズムについては不明です。私たちは同系担がんモデルを利用して、腫瘍組織内でヒスタミン合成が誘導されること、またH2受容体アンタゴニストは腫瘍組織の増大を抑制することを見いだしました。H2受容体アンタゴニストを投与したマウスでは、腫瘍組織内のTNF-αやIFN-γ誘導レベルが亢進しており、腫瘍組織内で産生されたヒスタミンは局所のサイトカイン産生を抑制することを通じてその作用を発揮すると考えられました(Takahashi, K. et al., Biochem. Biophys. Res. Commun., 2001 and 2002)。
一方、近年、HDC欠損マウスは化学発がんを起こしやすいことが報告されています。ここでは、腫瘍組織内のMDSC (Myeloid-derived suppressor cells)と呼ばれる免疫抑制性の集団がヒスタミン合成に関わること、ヒスタミンはMDSC自身の成熟を促進し、その結果免疫応答の抑制を解除することが示唆されています(Yang, X.D. et al., Nat. Med., 2011。これはヒスタミンが腫瘍免疫を増強するという仮説であり、H2受容体を介する免疫抑制作用とは反対の応答といえますが、関与する受容体を含め今後さらに検討が必要と言えるでしょう。免疫応答におけるヒスタミンの機能を考える上では、ヒスタミン産生が起こるタイミング、あるいは場の問題は極めて重要です。