研究内容



1. 受容体型チロシンキナーゼEphA2による細胞分裂制御
最大の受容体ファミリーを構成するエフリン(Eph)受容体は、受容体型チロシンキナーゼであり、個体発生において主に細胞増殖と遊走を制御し、組織再構築や血管新生、軸索誘導などの組織恒常性の調節に関わります。最も広く研究されている分子にEphA2があります。個体発生時において、肺、小腸、結腸、肝臓、腎臓、皮膚などでEphA2は発現しますが、分化した細胞にはあまり発現していません。EphA2のリガンドであるephrin A1はGPIアンカー型の膜係留タンパク質であり、ephrin A1とEphA2の結合には細胞–細胞間接着が必要です。この結合により誘導される細胞–細胞間の反発作用は、組織形成過程における細胞移動や領域形成に関与します[1]。
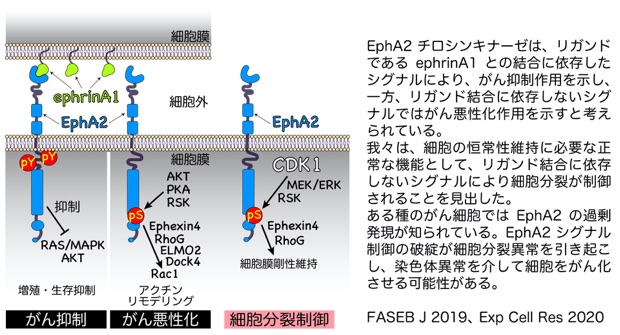
成体組織において発現が抑制されている一方、大腸がん、非小細胞肺がん、膵臓がん、乳がん、転移性メラノーマなどでEphA2が高発現していることが知られています。このようながん細胞では、リガンド刺激には依存せず、EGF、HGF、TNFαなどの増殖因子の刺激をトリガーとして、PKA、AKT、RSKによりEphA2のSer897残基がリン酸化され、Raf/MEK/ERK、Pyk2/c-Src/ERK、Akt/mTorc1などのシグナル経路の活性化により増殖・生存を亢進します[2][3]。さらに、リン酸化Ser897を起点として、Ephexin4/RhoG/ELMO2/Dock4/Rac1経路が活性化され、アクチンリモデリングを介して細胞の遊走にも寄与します[4]。このように、リガンドに依存しないシグナルはがんを悪性化させると考えられています。
私たちは、細胞分裂期においてCDK1/MEK/ERK経路依存的に、RSKによりSer897がリン酸化され、Ephexin4との結合を介してRhoGを細胞膜にリクルートし細胞膜の剛性を制御して紡錘体形成に関わることを報告しました[5][6]。細胞分裂期において細胞は球状化し、培養細胞の多くは細胞間接着が消失するため、細胞分裂期におけるEphA2のSer897のリン酸化はリガンド結合に依存せず、キナーゼ活性も必要としません。従って、リガンドに依存しないEphA2の機能は必ずしもがん化に寄与する機能のみではなく、正常な細胞活動においても必要であることが明らかになりました。
がん細胞におけるEphA2の過剰発現は、上述のように増殖因子の下流シグナル活性化に関わっていますが、がん細胞特有の細胞分裂制御にも関与する可能性があり非常に興味深い問題です。がん化学療法への展開も視野に入れながら、がん細胞の細胞分裂への関与について現在研究を進めています。
[1]E.B. Pasquale, Eph receptors and ephrins in cancer: bidirectional signalling and beyond., Nat. Rev. Cancer. 10 (2010) 165–80. https://doi.org/10.1038/nrc2806.
[2]H. Miao, D.Q. Li, A. Mukherjee, H. Guo, A. Petty, J. Cutter, J.P. Basilion, J. Sedor, J. Wu, D. Danielpour, A.E. Sloan, M.L. Cohen, B. Wang, EphA2 mediates ligand-dependent inhibition and ligand-independent promotion of cell migration and invasion via a reciprocal regulatory loop with Akt, Cancer Cell. 16 (2009) 9–20. https://doi.org/10.1016/j.ccr.2009.04.009.
[3]Y. Zhou, N. Yamada, T. Tanaka, T. Hori, S. Yokoyama, Y. Hayakawa, S. Yano, J. Fukuoka, K. Koizumi, I. Saiki, H. Sakurai, Crucial roles of RSK in cell motility by catalysing serine phosphorylation of EphA2., Nat. Commun. 6 (2015) 7679. https://doi.org/10.1038/ncomms8679.
[4]N. Hiramoto-Yamaki, S. Takeuchi, S. Ueda, K. Harada, S. Fujimoto, M. Negishi, H. Katoh, Ephexin4 and EphA2 mediate cell migration through a RhoG-dependent mechanism, J. Cell Biol. 190 (2010) 461–477. https://doi.org/10.1083/jcb.201005141.
[5]Y. Kaibori, Y. Saito, Y. Nakayama, EphA2 phosphorylation at Ser897 by the Cdk1/MEK/ERK/RSK pathway regulates M-phase progression via maintenance of cortical rigidity, FASEB J. 33 (2019) 5334–5349. https://doi.org/10.1096/fj.201801519RR.
[6]Y. Kaibori, K. Katayama, Y. Tanaka, M. Ikeuchi, M. Ogawa, Y. Ikeda, R. Yuki, Y. Saito, Y. Nakayama, Kinase activity-independent role of EphA2 in the regulation of M-phase progression., Exp. Cell Res. 395 (2020) 112207. https://doi.org/10.1016/j.yexcr.2020.112207.
研究内容1