「が ん」の克服を目指した治療開発研究
本学発のがん分子標的治療薬の創製
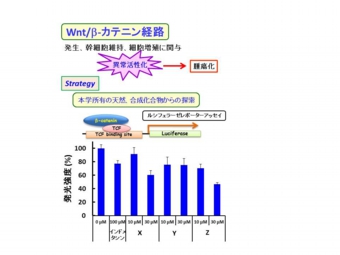
私たちは本学創薬科学系分野が所有する化合物ライブラリーから
Wnt/β-カテニン経路阻害化合物、ならびにがん転移抑制阻害化合物の
探索研究に本学創薬科学系分野と共同し取り組んでいます。
ヒット化合物を発掘し、構造活性相関解析および標的分子探索を行い、
本学発のがん分子標的治療薬を世界に発信いたします。
(1) Anticancer Res (2024) 44: 4789-4799
(2) Cancer Genomics Proteomics, (2024) 21: 158-165
(3) J Nat Med, (2024) 21: 158-165
(4) Cancer Genomics Proteomics, (2024) 21: 158-165
(5) Biochem Biophys Res Commun (2023) 638: 200-209
(6) Cancers (2022) 14: 566
(7) Biochem Biophys Res Commun (2022) 590: 49-54
(8) Biochem Biophys Res Commun (2022) 588: 147-153
(9) Bioorg Med Chem Lett (2021) 45: 128161
(10) Biochem Biophys Res Commun (2021) 535: 73-79
(11) J Nat Med (2020) 74: 689-701
(12) Anticancer Res (2019) 39:6507-6513
(13) Anticancer Res (2019) 39:5983-5990
(14) Int J Urol (2019) 26:138-139
(15) OncoImmunology (2018) 7:e1424671
(16) Biochem Biophys Res Commun, (2018) 496:490-496
(17) Biochem Biophys Res Commun (2017) 484:262-268
(18) BMC Cancer (2017) 16:748
(19) Biochem Biophys Res Commun (2016) 484:63-67
(20) Cancer Sci (2015) 106: 665-671.
造血器悪性腫瘍に対する新規治療法の開発
私たちは白血病や多発性骨髄腫といった造血器悪性腫瘍(血液がん)に対する新しい分子標的治療法の開発に取り組んでいます。
(1) Anticancer Res (2024) 44: 4789-4799
(2) Cancers (2022) 14: 566
(3) Biochem Biophys Res Commun (2022) 590: 49-54
(4) Biochem Biophys Res Commun (2022) 588: 147-153
(5) Leukemia (2021) 35: 2092-2096
(6) Int J Hematol (2020) 112: 714-719
(7) Biochem Biophys Res Commun, (2018) 496:490-496
(8) Biochem Biophys Res Commun (2017) 484:262-268
(9) Cancer Sci (2015) 106: 665-671.
(10) Leukemia (2013) 27:619-628.
がん幹細胞の根絶を目指した治療法の開発
(1) Anticancer Res, (2023) 43: 547-555
(2) Bioorg Med Chem Lett (2021) 45: 128161
(3) Anticancer Res (2019) 39:5983-5990
(4) Biochem Biophys Res Commun (2018) 496:490-496
(5) J Physiol Sci (2016) 66:387-396
エクソソームの生体内機能の解明
エクソソームとは、径100 nm前後の細胞内顆粒であり、多くのタンパク質やmRNA、miRNAを含有しており、
細胞間情報伝達顆粒として注目されています。私たちは、エクソソームの機能解析として、
悪性腫瘍の病態進展への関与を明らかにすべく研究を行っています。
(1) Anticancer Res (2025) in press.
(2) Front Oncol, (2023) 13: 1258442
(3) Chem Pharm Bull (Tokyo), (2023) 71: 819-823
(4) Cancers (2022) 14: 566
(5) Pharmaceutics (2020) 12: 545
(6) Biochem Biophys Res Commun (2015) 456:768-773.
γδT細胞を用いたがん免疫細胞療法の開発
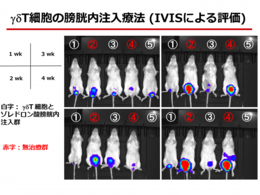
γδT細胞はT細胞の一種で寄生虫などの感染時、自然免疫機構に関わる細胞です。
このγδT細胞はビスホスホネート製剤 (BP) で大量培養可能で、
かつBP にて刺激した悪性腫瘍細胞に対して抗腫瘍効果を発揮します。
私たちは、γδT細胞を用いたがん免疫細胞療法の開発をめざし研究を行っています。
(1) Anticancer Res, (2023) 43: 547-555
(2) Biochem Biophys Res Commun (2022) 588: 47-54
(3) Biochem Biophys Res Commun (2021) 573: 132-139
(4) Int J Mol Sci (2021) 22: 8910
(5) Anticancer Res (2020) 40: 5481-5487
(6) Int J Urol (2019) 26:138-139
(7) Oncoimmunology (2018) 7: e1424671
(8) Biochem Biophys Res Commun (2015) 463:660-665.
「呼吸器感染症」の予防を目指した治療薬開発研究
気道線毛上皮細胞活性化薬の開発


気道線毛上皮細胞は、慢性閉塞性肺疾患 (COPD) や抗がん薬治療時には傷害を受けており、
その結果、COPD患者や抗がん薬投与を受けている患者では,
気道の感染防御を担う粘液線毛クリアランスの機能低下が生じ、
肺炎をはじめとする呼吸器感染症の易感染状態に陥っています。
私たちは、線毛細胞を活性化させる化合物を探索し、新たな感染予防策の開発に取り組んでいます。
(1) J Steroid Biochem Mol Biol (2026) 255:106871.
(2) Biol Pharm Bull (2025) 48: 657‑671
(3) Biol Pharm Bull (2024) 47: 2119-2126
