マスト細胞とは
私たちが注目しているマスト細胞とはどんな細胞でしょうか。マスト細胞は造血幹細胞に由来する血球系細胞ですが、マクロファージや樹状細胞と同様、組織に分布しています。血管が分布する組織であればほぼ全ての組織で見いだすことができます。蕁麻疹は局所におけるマスト細胞の活性化が原因ですが、身体の様々な部位で発症することからもマスト細胞が全身に分布していることがよく判ります。マスト細胞は1877年、ノーベル生理学・医学賞を受賞したPaul Ehrlich博士によって初めて報告されましたが、それはこの細胞が当時開発された新しい合成色素によって強く染色される顆粒を有していたからでした。

左図はEhrlich博士と、そのスケッチで、様々な組織に紫色の粒をもつ細胞が存在することが示されています。細胞質に顆粒を多数有することは、マスト細胞の大きな特徴の一つで、後述しますがこの顆粒の中には、強力な炎症性メディエーターであるヒスタミンや多数のプロテアーゼ、ヘパリンをはじめとする硫酸化プロテオグリカンが豊富に含まれています。当時はたくさんの顆粒は外部から物質を取り込んだ様子を表していると考えられたため、「大食細胞:Mastzellen」という名前がつけられ、これがMast Cellの語源となりました。
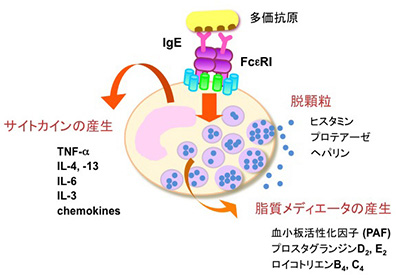 長らくマスト細胞の機能は不明でしたが、この細胞が即時型アレルギーにおいてヒスタミンを遊離する細胞であることが明らかにされてからは、アレルギー反応を起こす原因細胞として一躍注目を集めることとなりました。マスト細胞はIgEに対する高親和性受容体FcεRIを発現しており、IgEが結合した状態で組織で待機しています。IgEが標的とする抗原(アレルゲン)はIgEを介してFcεRIを架橋することにより、マスト細胞を活性化します。例えば、花粉症では、スギ花粉由来のタンパク質が抗原となってIgEを介したFcεRIの架橋が起こります。マスト細胞の活性化は分単位で起こる素早い反応と、刺激を受けて数時間後に起こる遅い反応があります。速やかに起こる反応については良く研究が進んでおりますが、「脱顆粒応答」と呼ばれるプロセスを経て、顆粒内部のヒスタミンをはじめとする炎症性のメディエーターが遊離します。ヒスタミンは強力な起炎物質であり、浮腫や発赤といった炎症に特徴的な症状を惹起します。くしゃみや鼻水、痒みといった花粉症の症状を思い出していただくと良いのですが、こうした症状が生じる上でヒスタミンは重要な役割を果たしています。ヒスタミンの作用をブロックする化合物(抗ヒスタミン、H1受容体アンタゴニスト)や、脱顆粒応答を抑制する化合物は、いずれも即時型アレルギーの治療薬として用いられています。この他、アラキドン酸代謝物をはじめとする脂質メディエーターや種々のサイトカインが活性化したマスト細胞から放出されます。サイトカインは免疫応答を制御する伝達物質として重要な分泌タンパク質ですが、マスト細胞は極めて多彩なサイトカインを産生する能力を有しています。マスト細胞から産生されるこれらサイトカインの個々の機能についてはまだ不明ですが、種々の免疫応答の調節に関わるのではないかと予想されています。
長らくマスト細胞の機能は不明でしたが、この細胞が即時型アレルギーにおいてヒスタミンを遊離する細胞であることが明らかにされてからは、アレルギー反応を起こす原因細胞として一躍注目を集めることとなりました。マスト細胞はIgEに対する高親和性受容体FcεRIを発現しており、IgEが結合した状態で組織で待機しています。IgEが標的とする抗原(アレルゲン)はIgEを介してFcεRIを架橋することにより、マスト細胞を活性化します。例えば、花粉症では、スギ花粉由来のタンパク質が抗原となってIgEを介したFcεRIの架橋が起こります。マスト細胞の活性化は分単位で起こる素早い反応と、刺激を受けて数時間後に起こる遅い反応があります。速やかに起こる反応については良く研究が進んでおりますが、「脱顆粒応答」と呼ばれるプロセスを経て、顆粒内部のヒスタミンをはじめとする炎症性のメディエーターが遊離します。ヒスタミンは強力な起炎物質であり、浮腫や発赤といった炎症に特徴的な症状を惹起します。くしゃみや鼻水、痒みといった花粉症の症状を思い出していただくと良いのですが、こうした症状が生じる上でヒスタミンは重要な役割を果たしています。ヒスタミンの作用をブロックする化合物(抗ヒスタミン、H1受容体アンタゴニスト)や、脱顆粒応答を抑制する化合物は、いずれも即時型アレルギーの治療薬として用いられています。この他、アラキドン酸代謝物をはじめとする脂質メディエーターや種々のサイトカインが活性化したマスト細胞から放出されます。サイトカインは免疫応答を制御する伝達物質として重要な分泌タンパク質ですが、マスト細胞は極めて多彩なサイトカインを産生する能力を有しています。マスト細胞から産生されるこれらサイトカインの個々の機能についてはまだ不明ですが、種々の免疫応答の調節に関わるのではないかと予想されています。
マスト細胞の分化
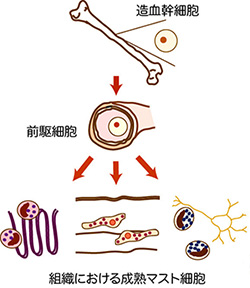 マスト細胞は骨髄の造血幹細胞に由来しますが、循環血中にはマスト細胞の特徴を有する細胞は検出されません。そのことから、マスト細胞は前駆細胞として骨髄を遊離し、組織に浸潤後成熟マスト細胞へと分化すると考えられています。循環血中に存在する前駆細胞については、その数が少ないことから詳細は明らかではありませんが、いくつか報告があります。マスト細胞を遺伝的に欠損するマウスへの培養マスト細胞の移植実験からは、移植先の組織の微小環境を反映したマスト細胞が生じてくることが報告されており、成熟マスト細胞の性格は周辺の環境に強く規定されていると推測されています。こうした報告は、マスト細胞はマクロファージと同様、分布組織によるヘテロ性を有することを示唆しています。即ち、ある組織におけるマスト細胞の機能を調べるためには、その組織に存在するマスト細胞の特徴を理解するところから研究を始める必要があるということです。
マスト細胞は骨髄の造血幹細胞に由来しますが、循環血中にはマスト細胞の特徴を有する細胞は検出されません。そのことから、マスト細胞は前駆細胞として骨髄を遊離し、組織に浸潤後成熟マスト細胞へと分化すると考えられています。循環血中に存在する前駆細胞については、その数が少ないことから詳細は明らかではありませんが、いくつか報告があります。マスト細胞を遺伝的に欠損するマウスへの培養マスト細胞の移植実験からは、移植先の組織の微小環境を反映したマスト細胞が生じてくることが報告されており、成熟マスト細胞の性格は周辺の環境に強く規定されていると推測されています。こうした報告は、マスト細胞はマクロファージと同様、分布組織によるヘテロ性を有することを示唆しています。即ち、ある組織におけるマスト細胞の機能を調べるためには、その組織に存在するマスト細胞の特徴を理解するところから研究を始める必要があるということです。
マスト細胞研究のアプローチ
マスト細胞は、即時型アレルギーの際に抗原刺激を受け、ヒスタミンを放出するという重要な機能をもつことから、当初の研究は「脱顆粒応答」のメカニズムを解析することに焦点がおかれました。株化マスト細胞は大別して二種の細胞があり、マスト細胞の増殖、分化に大きな影響を及ぼすサイトカインである幹細胞因子(Stem cell factor, SCF)の受容体であるc-kit遺伝子に変異を有しており、受容体型リン酸化酵素であるc-kitが常時活性型であるタイプと、増殖・維持にIL-3の存在が必須のタイプです。こうしたモデルのうち一部の細胞株は抗原刺激による脱顆粒応答を起こすことから、FcεRI下流のシグナル伝達、あるいは脱顆粒応答については細胞株を用いた研究により様々な知見が得られてきました。
一方、寄生虫感染の際には消化管粘膜にマスト細胞が動員されることが知られており、マウスではこの応答にはT細胞が産生するIL-3が必要であることが報告されています。この際のマスト細胞の増殖応答をin vitroで再現したものが、骨髄由来培養マスト細胞モデル(BMMC)です。マウス骨髄細胞をIL-3存在下、長期培養することによりほぼ100%に近いマスト細胞集団を得ることができます。このモデルは、細胞株のように無限に培養することはできませんが、細胞株と比較して生体内のマスト細胞の性質をより反映したモデルとしてよく用いられてきました。同様にES細胞やiPS細胞からもマスト細胞の誘導は可能であり、胎生致死を招くような遺伝子についても、そのマスト細胞における機能を調べることが可能となっています。
近年の強力な実験手法は、遺伝的にマスト細胞を欠失するマウスに培養マスト細胞を移植する再構成実験です。c-kit遺伝子に変異のあるマウスは、皮膚組織をはじめとして常在性のマスト細胞を欠失しています。こうしたマウスに局所的に、あるいは静脈内から同系の培養マスト細胞(特定の遺伝子の欠損マウス由来)を再構成することにより、マスト細胞の役割をin vivoで評価することができます。ただし、c-kitは血球系細胞の多くの初期分化に関与することから、c-kit変異モデルをそのままマスト細胞欠損モデルとして解析することの危険性が近年指摘されています。最近、様々なマスト細胞欠失モデルが新たに開発され、これらを用いてより正確なマスト細胞の機能評価が進んでいるところです。
マスト細胞培養モデル開発の意義
当研究室ではマスト細胞の培養モデルを開発していますが、その意義とは何でしょうか。マスト細胞欠失モデルを利用した近年の研究は、様々な生理現象、病態にマスト細胞が関与することを示してきました。しかし、一方でこうしたアプローチには限界があることも事実です。即ち、注目する現象へのマスト細胞の関与の有無、程度は解明できますが、マスト細胞がどのような刺激を受け、どのようなメディエーターを産生することにより、その生理現象を制御しているかを明らかにすることは困難であるということです。遺伝子欠損マウス由来の培養マスト細胞を移植するという実験系では、あらかじめ特定の遺伝子の関与を想定しなければ検証することはできません。また、マスト細胞の機能を標的とした創薬を企画する上では、適切なin vitroモデルの構築は必須と言えるでしょう。
参考文献
- Kitamura, Y. Heterogeneity of mast cells and phenotypic changes between subpopulations. Annu. Rev. Immunol. 7, 59-76, 1989
- Metcalfe, D. D. et al. Mast Cells. Physiol. Rev. 77, 1033-1079, 1997
- Galli, S. J. et al. Mast cells in the development of adaptive immune responses. Nat. Immunol. 6, 135-142, 2005
- Grimbaldeston, M. A. et al. Mast cell-deficient W-sash c-kit mutant KitW-sh/W-sh mice as a model for investigating mast cell biology in vivo. Am. J. Pathol. 167, 835-848, 2005
動物実験の一部を代替可能な成熟マスト細胞モデルの開発
マスト細胞は即時型アレルギーをはじめとする様々な疾患の発症、進展に関与する免疫細胞であり、様々な組織に分布しています。マスト細胞の最終分化は浸潤した組織の微小環境の影響のもと進むことから、生体内のマスト細胞はヘテロな性質を示します。即ち、ある疾患におけるマスト細胞の機能を標的とした創薬を進めるためには、疾患部位の組織マスト細胞の性質を反映したモデルが必要です。しかしながら従来は、がん細胞や細胞株といった、未成熟なマスト細胞のモデルしか存在しなかったため、スクリーニングの段階から動物を用いた評価を行わざるを得ませんでした。本技術は、皮膚組織に分布する成熟マスト細胞の性質を良く反映した培養マスト細胞を、マウス骨髄細胞から大量に調製する方法を提供するものです。
開発技術の優位性
本技術は従来の培養モデルにはない以下の特徴を有します。
- 皮膚組織のマスト細胞の特徴である、ポリカチオンや神経ペプチド刺激による脱顆粒応答を示す。(複数のMrgprサブタイプを発現することを確認している)
- 極めて高い顆粒プロテアーゼ(キマーゼ、トリプターゼ、カルボキシペプチダーゼA)活性を有する。
- 1回の培養操作で均質な10E8オーダーの成熟マスト細胞を調製できる。
- 初代培養モデルとしては異例の高い再現性を示す。
これらの特性を利用することにより、皮膚組織のマスト細胞の機能を標的とした医薬品候補のハイスループット解析が可能となり、従来必要であった動物実験による解析を大幅に削減することができます。
技術の市場性と将来性
マスト細胞の活性化がその進展に寄与することが実験的に示されている疾患には次のものがあります:即時型アレルギー(花粉症、喘息、食物アレルギー)、接触性皮膚炎、アトピー性皮膚炎、自己免疫疾患、がん、動脈硬化、糖尿病
本技術はこれらのうち、特に皮膚型マスト細胞が関与する疾患(皮膚炎、自己免疫疾患、がん等)に関する医薬品の評価系を提供するものです。マスト細胞を標的とした従来の医薬品は、IgEを介する抗原刺激による活性化応答を阻害するという作用機序のものであり、皮膚炎や蕁麻疹において認められる非IgE刺激によるマスト細胞の活性化を対象とした創薬は皆無です。本評価系を活用することにより全く新たな創薬領域が開拓される可能性があります。
近年、化学合成技術の進展に伴い、ナノマテリアルに代表される新化合物が相次いで登場していますが、これらの中には皮膚や呼吸器を通じて浸入し、アレルギー様症状を惹起するものもあります。本技術はそうした化合物による免疫毒性(偽アレルギー)の評価においても有用です。
関連する論文
私たちは先行研究(Levi-Schaffer, F. et al., Proc. Natl. Acad. Sci. USA, 1986, Murakami, M. et al., J. Biol. Chem., 1994)に基づき、マウス骨髄細胞をIL-3存在下、約1ヶ月間培養して得られる未成熟な培養マスト細胞(骨髄由来培養マスト細胞、Bone marrow-derived cultured mast cells; BMMCs)をマウス線維芽細胞株Swiss 3T3細胞とstem cell factor存在下、共培養することにより、皮膚組織に分布するマスト細胞に類似した成熟マスト細胞を得ることに成功しました(Takano, H. et al. FEBS Lett., 2008)。私たちの改変モデルは従来の培養法よりも安定しており、再現性が高いことが特徴です。
このモデルは、マウスマスト細胞の成熟過程を反映すると考えられることから、網羅的な遺伝子発現変化を解析し、マスト細胞の最終分化を制御する遺伝子を探索しました。CD44はヒアルロン酸受容体としても知られる膜タンパク質ですが、これは比較的早い段階から誘導されます。遺伝子欠損マウスを用いて解析したところ、CD44は成熟過程におけるマスト細胞の増殖に必要であり、実際に遺伝子欠損マウスの皮膚組織ではマスト細胞数が減少することが分かりました(Takano, H. et al., Lab. Invest., 2009)。一方で、フィーダー細胞であるSwiss 3T3のヒアルロン酸合成酵素、HAS-2をノックダウンすると、共培養時のマスト細胞の増殖が増強される(Takano, H. et al., Biol. Pharm. Bull., 2012)ことから、皮膚組織におけるマスト細胞数はヒアルロン酸の濃度によって正負に精妙に制御されている可能性が考えられました。
マスト細胞の成熟過程ではGfi1という転写因子が誘導され、Gfi1bという転写因子の発現が低下しますが、強制発現細胞を用いた解析から両者はヒスタミン合成やトリプターゼレベルの制御に関わることが分かりました(Taura, A. et al., Biol. Pharm. Bull., 2014)。私たちはマスト細胞におけるヒスタミン合成が自身の顆粒成熟に必要であることを報告していますが、この解析においてもこの共培養モデルを活用しました(Nakazawa, S. et al., Eur. J. Immunol., 2014)。
対象特許
- 登録番号:特許6011815
- 発明の名称:成熟マスト細胞の製造方法
- 出願人:国立大学法人岡山大学
- 発明者:田中智之
参考文献
Restriction of mast cell proliferation through hyaluronan synthesis by co-cultured fibroblasts. Takano, H., Furuta, K., Yamashita, K., Sakanaka, M., Itano, N., Gohda, E., Nakayama, K., Kimata, K., Sugimoto, Y., Ichikawa, A., and Tanaka, S. Biol. Pharm. Bull. 35, 408-412, 2012