研究概要 Study
研究概要
細胞内シグナル伝達は転写制御を介して細胞増殖やアポトーシス、サイトカインや成長因子等の発現をコントロールします。ユビキチン・プロテアソームシステムは、このシグナル伝達制御や蛋白質分解、エンドサイトーシス、DNA修復、免疫を制御する重要な細胞機能です。これら細胞内シグナル伝達やユビキチン・プロテアソームシステムの異常は細胞がん化を誘導することになります。また、腫瘍ウイルスはこれらの細胞機能を破綻させて、細胞増殖の異常亢進、アポトーシス阻害、トランスフォーム活性、免疫回避を行います。私たちは、細胞内シグナル伝達とユビキチン・プロテアソームシステム、さらに、ウイルス性発がんに関連した研究を行っています。
1. ユビキチン化等の細胞内翻訳後修飾とプロテアソームによる蛋白質分解機構の解析
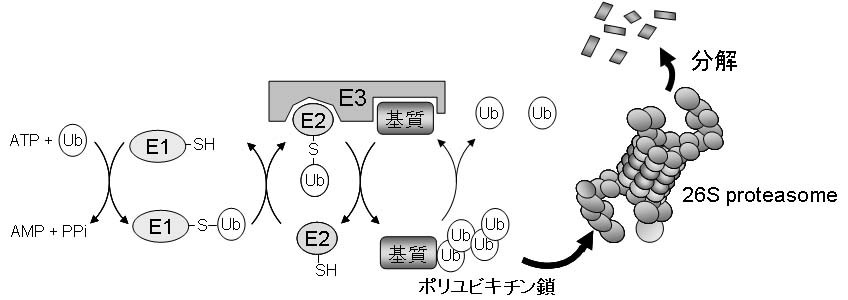
ユビキチン化翻訳後修飾とは、ユビキチン活性化酵素(E1)、ユビキチン結合酵素(E2)およびユビキチンリガーゼ(E3)からなるユビキチン付加酵素群によって多数のユビキチン分子からなるポリユビキチン鎖が標的蛋白質に付加される翻訳後修飾システムです。これらE1-E2-E3の一連の反応により、標的蛋白質の残基にユビキチンが共有結合し(ユビキチン化)、さらに共有結合したユビキチンのLys残基にユビキチンが共有結合し、このユビキチン化の反応が繰り返されてポリユビキチン鎖が形成されます。ユビキチン分子内には7個のLys残基が存在し、どのLys残基を介してポリユビキチン鎖が形成されるのかにより、ユビキチン化は複数の機能を持ちます。例えば、Ub分子内の48番目のLys残基を介して形成されるポリユビキチン鎖(K48ポリユビキチン鎖)は、26Sプロテアソームによって認識され、分解シグナルとして働きますが、63番目のLys残基を介して形成されるポリユビキチン鎖は、シグナル伝達、エンドサイトーシス、DNA修復に関与すると言われています。私たちは、ユビキチンやUBL(Ubiquitin like protein)といったモディファイアー分子による翻訳後修飾とプロテアソームによる蛋白質分解の機構と生理的役割について研究を行っています。
2. 発がんに関わる細胞内シグナル伝達の解析
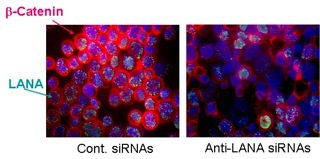
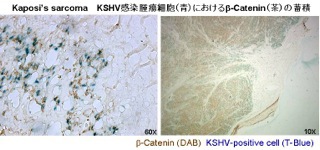
Wntシグナルは胚発生や体細胞分裂の盛んな組織において活性化され、体軸の決定、器官形成および細胞増殖に必須のシグナル伝達です。Wntシグナルのシグナル伝達因子であるβ-カテニンは、乳がん、大腸がん、肝がん等の様々な腫瘍組織において、過剰蓄積が観察され、その原因とされています。さらに、その過剰蓄積の原因はβ-カテニンの安定化を誘発する遺伝的変異であり、Wntシグナルの異常と発がんは密接に関連していると言えます。私たちの体を構成する正常細胞では、β-カテニンの不安定化による負の制御が働き、Wntシグナルは抑制されています。つまり、β-カテニンはGSK-3 β-APC-Axin複合体によりリン酸化され、このリン酸化がSCF複合体と呼ばれるユビキチンリガーゼE3が行うK48ポリユビキチン化のシグナルとなります。そして、ポリユビキチン化されたβ-カテニンは26Sプロテアソームにより迅速に分解されることでWntシグナルは抑制されるのです。しかし、家族性大腸がんを発症する患者さんのβ-カテニン遺伝子は変異が起こり、GSK-3 β-APC-Axin複合体によるリン酸化を受けないβ-カテニンが発現しています。また、多くの腫瘍ウイルスが、感染細胞内のβ-カテニン安定化を惹起して感染細胞のがん化を誘導します。Wntシグナルの他に、NF-kB、MAPK、JAK-STAT、Notchシグナル伝達の制御の破綻も発がんを誘導することが知られています。私たちは、これら発がんに関わるシグナル伝達の機構解析、さらに、がんウイルスとの相互作用について解析を行っています。
3. がんウイルスの発がん機構の解析
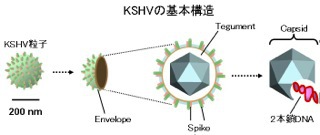
最近の研究から、多くのがんウイルスの遺伝子産物が、宿主細胞のシグナル伝達や免疫応答を利用する(または破綻させる)ウイルスの戦略が明らかになってきました。がんウイルスは細胞の増殖やアポトーシスを制御するシグナル伝達、抗原提示、さらに、それらの制御の中心となるユビキチン・プロテアソームシステムを脱制御します。これらの行為により、ウイルスは細胞をウイルス自身にとっての好環境に再構築するのです。この様な戦略、つまりウイルス性蛋白質が細胞性の制御因子として機能し、細胞機能を乗っ取る行為を海賊行為に例え、Molecular Piracy(分子海賊)と言われ、その仕組みを研究しています。
4. カポジ肉腫関連ヘルペスウイルス複製機構の分子基盤の解明
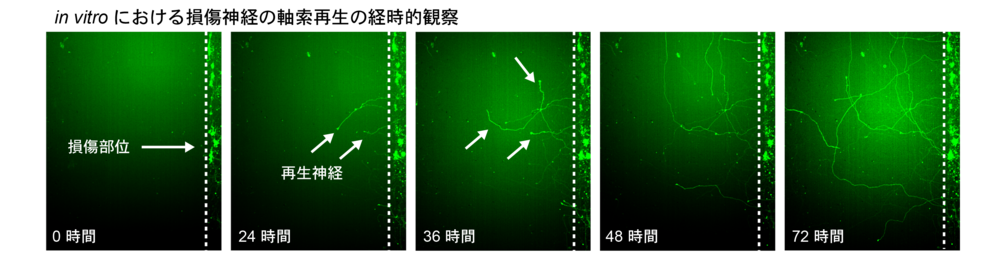
4. 神経細胞の軸索再生を促進または抑制する調節機構の解明