研究内容

腸管出血性大腸菌の産生する小胞体ストレス誘導毒素 SubAB の
細胞傷害機構の解明
腸管出血性大腸菌は、日本で毎年3000~4000人の感染者が報告される食中毒の原因菌の一つです。その中でも、O157:H7 は、代表的な血清型の一つで、下痢、血便、重症化すると尿毒症症候群(HUS)、脳症を引き起こす志賀毒素(Stx)を産生することが知られています。更に、最近、非典型であるO113:H21 による感染例も世界的に増加傾向にあります。この非典型腸管出血性大腸菌の中には、志賀毒素以外に、小胞体ストレス誘導毒素(SubAB)を持つものがいます。
我々は、この SubAB の細胞傷害機構の解析をCRISPER CAS9 KO ノックアウト細胞によるスクリーニング、RNAseqによる遺伝子変化を詳細に解析して、その阻害剤の開発、新たな生命現象の発見に力を入れています。
腸管出血性大腸菌感染モデルマウスの樹立と感染発症メカニズムの解明
腸管出血性大腸菌感染症は、抗菌薬治療によって病態の増悪化(志賀毒素の産生亢進)が認められる菌株もあることから、コンセンサスな治療法は確立されていない。そのため、適切な治療法を確立するための感染モデル確立が急務である。これまで、多くの感染モデルが試みられているが、人と同じような病態が現れる物は少ない。ここでは、千葉大学、国立感染症研究所との共同研究により腸管出血性大腸菌感染モデルマウスを構築し、その病態発症機構を解明し、有効な抗菌薬の検索、投与のタイミングなど詳細に解明していく。
コレラ菌の新規ADPリボシル化毒素 Cholix の宿主傷害機構の解明

細胞致死毒素 Cholix はコレラ菌が産生する新たな ADP-リボシル化毒素である。
我々は、精製した Cholix を用い、細胞死に至るシグナル伝達機構を解析している。その結果、Cholix よる致死活性 (アポトーシスあるいはネクローシス) は細胞種により異なっており、ヒト子宮上皮細胞由来 HeLa 細胞に対しては炎症性カスパーゼの活性化を起点としたミトコンドリア依存と非依存性の二つの異なる経路を介したアポトーシスを誘導することが明らかになっています。
Cholix をマウスへ投与すると、肝臓特異的な致死性肝炎を引き起こ致死に至る。肝臓癌由来 HepG2 細胞に対する致死作用は、炎症性サイトカイン TNF-alpha の添加により、劇的に更新し、アポトーシスを引き起こすことを報告してます。また、Cholix 結合蛋白質として Prohibitin を同定し、この蛋白質はミトコンドリア膜上で、ROS の産生に関与し、Cholix の細胞致死に関与していることを明らかにしてます。
現在、CrisperCAS9 ノックアウトライブラリーを導入した細胞から、Cholix 致死耐性細胞を樹立し、致死必須遺伝子の解析を行い、新たな細胞致死機構の解明、受容体の同定を進めています。
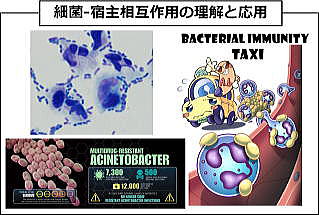
アシネトバクターの病原性獲得機序の解明
現在、薬剤耐性菌が世界的に問題になっており、2050年には、1000万人が死亡すると言われている。アシネトバクター属菌は、薬剤耐性を獲得しやすく、また高い環境適応能を有していることから、院内感染の原因となりやすい。
アシネトバクター属菌は、免疫力の低下した易感染宿主に感染した場合は、高頻度に肺炎や敗血症を引き起こす。我々は、これまで細菌と宿主免疫細胞の相互作用に着目し、アシネトバクター属菌が、宿主免疫機構を巧みに回避するユニークな病原性を多数有していることを明らかにしてきた。その中で、アシネトバクターが好中球をタクシーのように利用することで生体内を移動し、敗血症や感染拡大を引き起こす新規細菌移動メカニズム“Bacterial immunity taxi”を世界にさきがけて発した。
今後、細菌-宿主相互作用をターゲットにした新規感染症治療/制御戦略の確立を目指す。さらに、現在、本細菌のユニークな環境適応能や病原性獲得機序を次世代シークエンサーを用いたゲノム解析や RNAseq により解析を進めている。