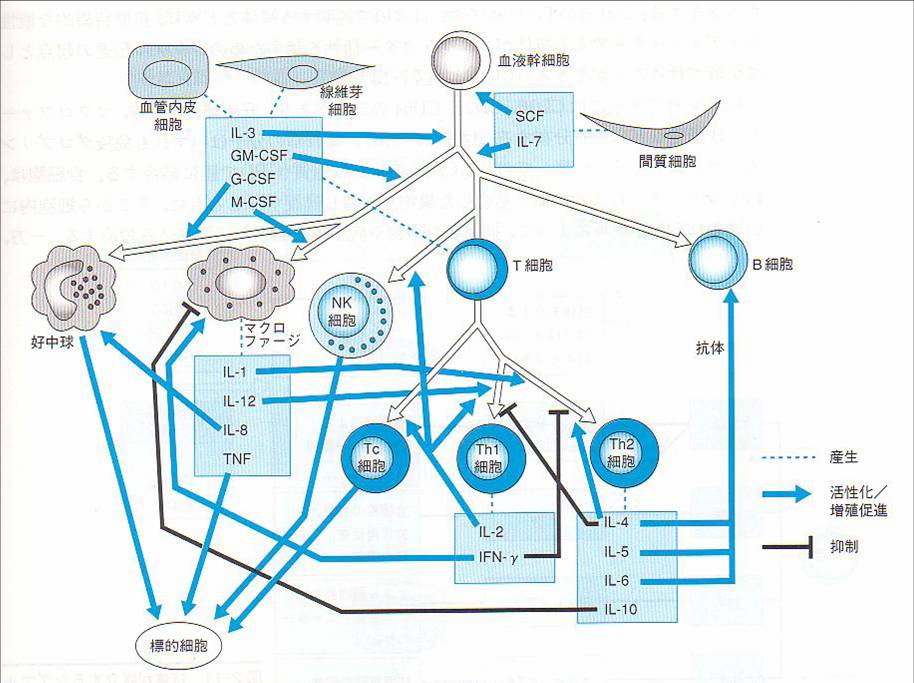
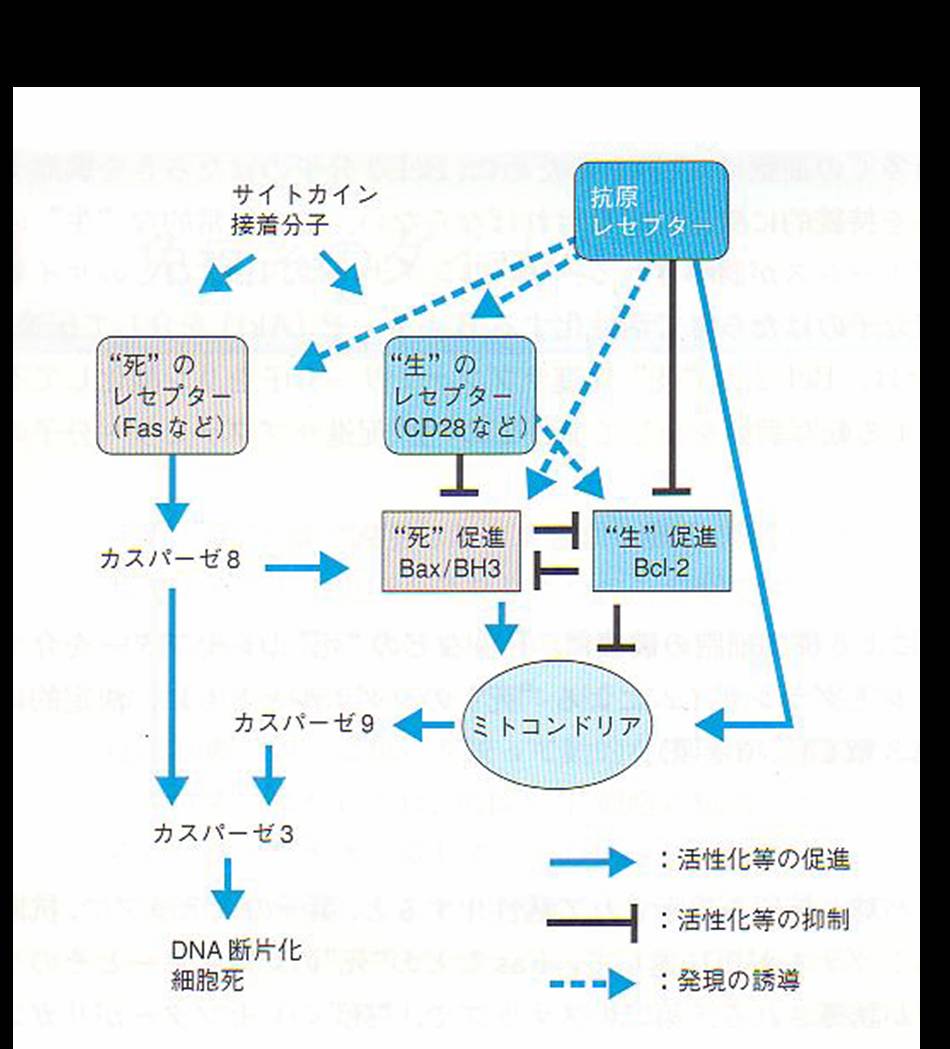
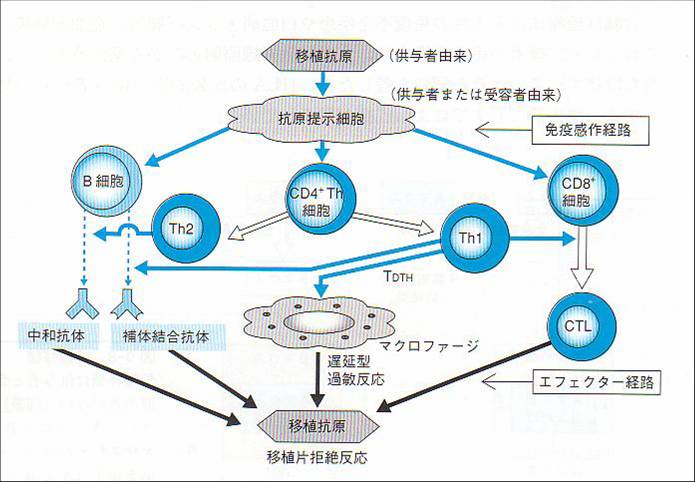
仱柶塽椕朄
堏怉偝傟偨採嫙幰乮僪僫乕乯偺柶塽嵶朎偑丄偑傫嵶朎傪峌寕偡傞偙偲傪慱偆傕偺偱丄偄傢偽堏怉偵傛傞柶塽椕朄丅寣塼偑傫偩偗偱側偔丄屌宍偑傫偵傕岠壥偑婜懸偱偒傞偲偄偆丅丂憿寣姴嵶朎堏怉偱偼傑偢丄捠忢偺悢攞偐傜悢廫攞傕偺戝検偺峈偑傫嵻搳梌傗曻幩慄徠幩偱偑傫嵶朎傪揙掙揑偵偨偨偔乽慜張抲乿傪峴偆丅偙傟偵敽偄丄憿寣慻怐偺崪悜傕攋夡偝傟傞偨傔丄敀寣媴側偳偺尦偵側傞憿寣姴嵶朎傪堏怉偟偰曗偆丅丂偟偐偟丄慜張抲偼崪悜埲奜偵傕惓忢側憻婍傗慻怐傪捝傔偮偗傞丅姵幰偺晧扴偼戝偒偔丄巰偵帄傞偙偲傕偁傞傎偳丅偙偺偨傔丄堏怉姵幰偼暃嶌梡偵懴偊傜傟傞俆俆嵨傑偱偲惂尷偝傟丄廳偄憻婍忈奞偺偁傞恖傕堏怉偼柍棟偩偭偨丅丂
仱儅僀儖僪側帯椕朄
丂丂偙偺惂栺傪攋偭偰偔傟偦偆側偺偑儈僯堏怉丅憿寣姴嵶朎偲堦弿偵堏怉偝傟傞儕儞僷媴偺曽偑丄慜張抲偺寖偟偄壔妛椕朄側偳傛傝傕丄偑傫嵶朎傪峌寕偡傞椡偑嫮偄偲偺嵟嬤偺尋媶寢壥偵婎偯偔丅慜張抲傪寉偔梷偊丄儕儞僷媴偵傛傞峌寕乮俧倁俴岠壥乯傪備偭偔傝桿摫偡傞儅僀儖僪側帯椕朄偩丅丂偨偩丄堏怉儕儞僷媴傕偑傫嵶朎偩偗偱側偔惓忢慻怐傪峌寕偡傞偨傔丄柶塽梷惂嵻偺旝柇側偝偠壛尭側偳丄嵶怱偺拲堄偑昁梫偵側傞丅丂暃嶌梡偑寉偄偨傔丄堏怉偺揔墳擭楊偼俈侽嵨傑偱峀偑傞偲尵傢傟偰偄傞丅丂
憿寣姴嵶朎堏怉偼庡偲偟偰敀寣昦傗嵞惗晄椙惈昻寣偵懳偟偰峴傢傟偰偄傞偑
丒乽偳偙偐傜偲偭偰偒偨憿寣姴嵶朎偐乿丄
丒乽偩傟偐傜偲偭偰偒偨憿寣姴嵶朎偐乿偱暘椶丅
丒
崪悜偐傜庢偭偰偒偨憿寣姴嵶朎偺桝寣 仺 崪悜堏怉
枛徑寣拞偺憿寣姴嵶朎傪廤傔偰桝寣 仺 枛徑寣姴嵶朎堏怉
鋊懷寣拞偺憿寣姴嵶朎傪廤傔偰桝寣 仺 鋊懷寣堏怉
丒
帺暘帺恎偺憿寣姴嵶朎傪庢偭偰偍偄偰桝寣 仺 帺壠堏怉
懠恖偐傜憿寣姴嵶朎傪傕傜偭偰桝寣 仺 摨庬堏怉
帺壠堏怉埲奜偼堏怉慜偵嫮椡側峈娻嵻傗曻幩慄徠幩偱帺屓偺崪悜傪崻愨偟偰偐傜峴傢側偄偲俧倁俫俼偵偰抳柦揑側寢壥偲側傝偆傞丅
傛偭偰丄峴偊傞擭楊丄弍慜忬懺偑惂栺偝傟傞丅
侾乯憿寣姴嵶朎堏怉偺庬椶乮僪僫乕偺庬椶乯
乑帺壠堏怉乮Autologous transplant丟Auto乯
崪悜攋夡揑慜張抲偺屻偺崪悜柍宍惉忬懺偵丄偁傜偐偠傔嵦庢曐懚偟偰偍偄偨帺屓偺乮崪悜丄枛徑寣乯憿寣姴嵶朎傪桝拲偟偰憿寣傪嵞峔抸偡傞曽朄丅堏怉曅懳廻庡昦(graft-versus-host
disease丟GVHD)偑側偔丄柶塽夞暅偑懍偄偺偱娫幙惈攛墛偺崌暪偑彮側偄棙揰偑偁傞偑丄堏怉曅拞傊偺庮釃嵶朎偺崿擖偺婋尟傗堏怉曅懳敀寣昦 (graft-versus-leukemia丟GVL)岠壥偑側偔嵞敪棪偑崅偄丅
乑摨庬堏怉乮allo丟Allogeneic transplant乯
埆惈庮釃偺帯椕偵偍偄偰丄挻戝検偺壔妛丒曻幩慄椕朄偱庮釃嵶朎傪崻愨偟偨屻偵惗偠傞崪悜柍宍惉忬懺傗丄検揑丒幙揑堎忢偺偁傞姵幰偺憿寣姴嵶朎傪丄HLA揔崌donor偐傜偺惓忢側憿寣姴嵶朎偱丄抲姺偟偰惓忢側憿寣擻傪嵞峔抸偡傞曽朄丅堏怉偺嵺偺GVHD
(graft-versus-host disease)偵懳偟偰柶塽梷惂嵻傪搳梌偡傞丅GVL (graft versus leukemia)岠壥偑婜懸偱偒傞丅
丂丒 寣墢幰乮related乯
HLA1嵗晄堦抳傑偱揔墳丅堏怉帪婜偺挷惍偑梕堈偱丄堏怉嵶朎悢傕廫暘婜懸偱偒丄媫惈GVHD偼斾妑揑寉偔丄GVHD娭楢幘姵傕彮側偄偑丄GVL岠壥偼婜懸偱偒傞丅惗拝晄慡偼傑傟偱丄嵞堏怉傕壜擻丄嵞敪屻偺DLI
(donor lymphocyte infusion)偼壜擻偱偁傞丅
丂丒 旕寣墢幰乮unrelated乯
崪悜僶儞僋偲鋊懷寣僶儞僋偑偁傞丅
仠 崪悜僶儞僋
僪僫乕僐乕僨傿僱乕僩偵暯嬒220擔偐偐傝丄堏怉帪婜偺挷惍偑崲擄偱丄堏怉嵶朎悢偑彮側偄偙偲偑偁傞丅丂HLA偼DNA堦抳偑朷傑偟偔丄媫惈GVHD偼廳徢偵惉傝堈偔丄娭楢崌暪徢傕懡偄丅椙惈幘姵偱惗拝晄慡偑傗傗懡偄丅嵞敪屻偺俢俴俬偼尰帪揰偱偼侾夞偩偗壜擻丄GVL岠壥偼HLA堦抳摨朎傛傝嫮偄丅
仠 鋊懷寣僶儞僋
僪僫乕僐乕僨傿僱乕僩偵梫偡傞婜娫偑抁偔乮暯嬒0.5乣1儢寧乯嬞媫揑堏怉偵懳墳偱偒丄搥寢曐懚側偺偱堏怉帪婜偺挷惍偼梕堈偱偁傞丅憿寣夞暅偑抶偔丄惗拝傑偱暯嬒20擔掱搙偐偐傝丄摿偵寣彫斅偺夞暅偑抶偄丅椙惈幘姵偵嫅愨偑懡偄偑嵞堏怉偼晄壜擻丅尦偺鋊懷寣偺検偑彮側偄偺偱丄懱廳偺廳偄姵幰偱偼堏怉惉愌偑晄椙丅HLA2嵗晄堦抳傑偱揔墳偩偑丄GVHD偺昿搙偼掅偔丄掱搙傕寉偄丅帣偺僼僅儘乕傾僢僾婜娫偑抁偔丄堏怉偵傛傞愭揤惈幘姵宲彸偺壜擻惈偼枹抦偱偁傞丅尨懃偲偟偰僪僫乕傊偺怤廝偼側偄偑丄鋊懷寣傪嵦庢曐懚偡傞偨傔偺懡妟偺旓梡偲愝旛傪昁梫偲偡傞丅嵞敪屻偺DLI偼晄壜擻丅
丂俀乯巊梡偡傞憿寣姴嵶朎偺庬椶丒 崪悜堏怉乮bone marrow transplastation;BMT乯丗嵦庢帪偵丄慡恎杻悓壓偱偺崪悜慂巋乮800ml慜屻乯傪峴偆偨傔丄4乣5擔娫偺擖堾傪梫偡傞丅傑偨丄慜傕偭偰帺屓寣桝寣傪梡堄偡傞昁梫偑偁傞丅僪僫乕巰朣椺偺曬崘乮怱掆巭丒怱幒嵶摦丒傾僫僉儔僼傿僔乕僔儑僢僋丒弍屻攛嵡愷乯偑偁傞丅惗拝傑偱偵梫偡傞婜娫偼暯嬒18擔掱搙丅姵幰偺曽偑僪僫乕傛傝懱廳偑廳偄偲丄廫暘側嵶朎悢偑摼傜傟側偄偙偲偑偁傞偑丄堏怉屻挿婜偺憿寣擻偺堐帩偵娭偟偰偼丄徹柧嵪傒偱偁傞丅丂
丒 枛徑寣姴嵶朎堏怉乮peripheral blood stem cell transplantation;PBSCT乯丗嵦庢偺偨傔偵丄G-CSF傪4乣6擔娫搳梌偟丄1乣3擔娫偺傾僼僃儗乕僔僗傪峴偆丅偦偺偨傔丄7乣10擔娫偺擖堾傪梫偡傞丅G-CSF偵傛傞抁婜揑側暃嶌梡乮崪捝丒敪擬側偳乯偑弌尰偟偨傝丄傾僼僃儗亅僔僗偵敽偆掅Ca寣徢傗寣彫斅尭彮偑弌尰偡傞偙偲傕偁傝丅悽奅偱俀椺偺巰朣椺乮擼寣娗忈奞丒怱掆巭乯偺曬崘偁傝丅僪僫乕偺挿婜揑側埨慡惈偵偮偄偰偼晄柧丅搥寢曐懚偱偒傞偺偱丄堏怉帪婜偺挷惍偑偱偒傞丅僪僫乕偺姴嵶朎摦堳岠棪偵傛傝丄嵶朎悢偑傑偪傑偪丅憿寣夞暅偼懍傗偐偱丄惗拝傑偱暯嬒侾係擔掱搙丅摨庬堏怉偱偼枬惈GVHD偑懡偄偑丄敀寣昦嵞敪偑彮側偄孹岦偑偁傞丅堏怉屻挿婜偺憿寣擻堐帩偱偒傞偐偳偆偐偼枹専徹丅旕寣墢幰偱偼尰嵼慖戰晄壜擻偱偁傞丅
枛徑寣姴嵶朎
棙揰丒嵦庢傪偡傞偺偵慡恎杻悓傪昁梫偲偟側偄丅偙傟偵娭楢偟偰孞傝曉偟偺嵦庢偑壜擻偱偁傞丅
丒帺壠枛徑寣姴嵶朎堏怉偱偼丄帺壠崪悜堏怉偵斾傋偰憿寣擻偺夞暅偑憗偄丅
丒偁傞庬偺幘姵偵懳偟偰偼丄摨庬枛徑寣姴嵶朎堏怉偼摨庬崪悜堏怉傛傝傕柍昦惗懚棪偑傛偄 (GVLE 偵傛傞岠壥偺偨傔)
栤戣揰
丒偳傫側偵偑傫偽偭偰傕丄堏怉偵昁梫側偩偗枛徑寣姴嵶朎傪嵦庢偱偒側偄働乕僗偑偁傞丅( Poor Mobilizer)丒崪悜堏怉傛傝傕夞暅偑憗偄
= 崪悜偵偄傞憿寣姴嵶朎偲偼惈奿偑堘偆仺 杮摉偵峆媣揑側憿寣擻偺夞暅偑摼傜傟傞偺偐 ? 偲尵偆媈栤丒懠恖偐傜枛徑寣姴嵶朎傪傕傜偆応崌丄僪僫乕 偵岲拞媴僐儘僯乕巋寖場巕
( G-CSF丄彜昳柤僌儔儞丄僲僀僩儘僕儞丄僲僀傾僢僾側偳 ) 傪搳梌偟偰偐傜嵦庢丅乽杮摉偵寬忬恖偵戝検偺 G-CSF 傪搳梌偟偰埨慡偐乿偲尵偆栤戣偺夞摎偼傑偩摼傜傟偰偄側偄丅
鋊懷寣堏怉
棙揰
丒姰慡偵 HLA 偑揔崌偟偰偄側偔偰傕堏怉偱偒傞壜擻惈偑偁傞 ( HLA 2 嵗晄堦抳偔傜偄側傜堏怉偱偒傞壜擻惈偑崅偄
)丒傕偲傕偲幪偰傞傕偺乮嵟嬤偱偼偦偆偲偼尵偊側偄偑乯偱丄採嫙幰偺晧扴偑傎偲傫偳側偄丅丒椻憼屔偺拞偱惷偐偵偹傓偭偰偄傞偩偗偁傝丄搊榐偐傜堏怉傑偱偺帪娫偑抁帪娫偱嵪傓丅
( 恖偐傜傕傜偆偙偲偵側傞偲丄僪僫乕偺搒崌傗嵦庢巤愝偺搒崌側偳偱擔掱偺挷惍偵帪娫偑偐偐傝傑偡偑丄鋊懷寣堏怉偱偼偙偺傛偆側帪娫偺儘僗偑傎偲傫偳側偄)
抁強丒堏怉屻偺憿寣擻偺夞暅傗柶塽擻偺夞暅偑丄崪悜堏怉傗枛徑寣姴嵶朎堏怉偵斾傋偰偐側傝抶偄 ( 拞墰抣偱 敀寣媴
> 500/兪l 偵 30 擔掱搙丄寣彫斅 > 20000/兪l 偵 60擔掱搙 )丅丒嵦庢偱偒傞検偵尷傝偑偁傞偺偱 丄懱偺戝偒偄僸僩偵偼昁梫側偩偗偺嵶朎悢傪梡堄偱偒側偄
( 捠忢偱偼丄姵幰偝傫偺懱廳偑偣偄偤偄 50kg 掱搙傑偱偑堦偮偺栚埨丄偨偩偟幚嵺偵偼 80kg 偔傜偄偺姵幰偝傫偵傕峴傢傟偰偄傞 )丅丒戝検偺鋊懷寣傪曐懚偡傞偺偵偼偍嬥偑偐偐傞
( 晛捠偺椻憼屔偵曐懚偡傞傢偗偵偼偄偐側偄 )丅
乮儈僯堏怉乯
摨庬憿寣姴嵶朎堏怉偺栚揑偑丄乽僪僫乕偺 Tcell 偺摥偒偵傛傞柶塽妛揑側婡彉偵埶懚偟偨巆懚庮釃嵶朎偺嬱拃乿偱偁傞偲偡傟偽丄乽偳偆偣偳傫側偵壔妛椕朄丒曻幩慄椕朄傪峴偭偨偲偙傠偱丄庮釃嵶朎偑巆傞偺側傜丄嵟弶偐傜乽僪僫乕偺
Tcell 偺摥偒偵傛傞柶塽妛揑側婡彉偵埶懚偟偨巆懚庮釃嵶朎偺嬱拃乿偩偗傪栚揑偵帯椕偟偨傜偄偄偺偱偼側偄偐乿偲尵偆峫偊丅偙傟傑偱偺摨庬堏怉偺擭楊惂尷偼偍傕偵丄摨庬堏怉慜偵峴傢傟傞壔妛椕朄丒曻幩慄椕朄偺暃嶌梡偵傛傞傕偺丅偙傟傪寉偔偟丄偐偮僪僫乕偺憿寣姴嵶朎偑嫅愨偝傟側偄傛偆偵丄姵幰偝傫偺
Tcell 偩偗傪廩暘偵嶦偟偰偍偗偽丄偐側傝崅楊偺姵幰偝傫傗慡恎忬懺偑偁傑傝傛偔側偄姵幰偝傫偵傕摨庬堏怉偑壜擻偵側傞丅
摨庬堏怉慜偵峴傢傟傞壔妛椕朄丒曻幩慄椕朄 ( = 堏怉慜張抲丄慜張抲) 傪寉偔偟偰丄姵幰偝傫偺 Tcell
偩偗傪廩暘偵嶦偟偰嫅愨傪杊偄偱堏怉偡傞曽朄傪乽儈僯堏怉乿偲偐丄乽旕崪悜攋夡揑慜張抲 ( Nonmyeloablative preparative
regimen ) 偵傛傞摨庬堏怉乿側偳偲屇傫偱偄傞丅偙偺儈僯堏怉偱偼丄堏怉屻姵幰偝傫帺懱偺憿寣姴嵶朎傪偼偠傔偲偡傞奺庬偺寣塼嵶朎偲丄僪僫乕偺憿寣姴嵶朎偺椉曽偑姵幰偝傫偺懱偵摨嫃偟偰偄傞忬懺偑婲偙傞丅偙傟傪乽崿崌僉儊儔乿偲尵偆丅帪娫偑宱偮偵偮傟丄僪僫乕桼棃偺
Tcell 偺摥偒偵傛傝丄彊乆偵姵幰偝傫桼棃偺憿寣姴嵶朎傗庮釃嵶朎偑巰傫偱峴偔偼偢丄偲備偆傛傝巰傫偱峴偔傛偆偵僐儞僩儘乕儖偡傞丅偮傑傝寉偄 GVHD
偑偼偠傔偐傜婲偙傞傛偆偵傕偔傠傓丅GVHD 傪堷偒婲偙偡曽朄偼忋弎偺偲偍傝丄傑偢偼柶塽梷惂嵻傪尭検偡傞丄偙傟偱 GVHD 偑婲偙傜側偗傟偽丄DLI
傪峴偆丅
儈僯堏怉偺栤戣揰
傑偢丄姰慡偵妋棫偝傟偨曽朄偱偼側偔丄尰嵼偦偺曽朄偑尋媶搑拞偱偁傞丅慡恎忬懺偑椙岲側庒偄姵幰偝傫偱偼丄傎傏妋棫偝傟偨姶偺偁傞捠忢偺摨庬憿寣姴嵶朎堏怉傪慖傇偺偑堦斒揑丅乽慡恎忬懺偑捠忢偺堏怉慜張抲偵懴偊傜傟側偄偐傜儈僯堏怉傪慖戰偡傞乿抜奒偱偼丄捠忢偺堏怉偲摨偠傛偆偵儕僗僋傪晧偆偲峫偊傞傋偒丅
摿偵媫惈敀寣昦側偳偺傛偆偵丄庮釃偺憹怋僗僺乕僪偑憗偄応崌偼丄寉偄堏怉慜張抲偟偐峴傢側偄儈僯堏怉偱偼丄GVLE
敪尰偺慜偵嵞敪偡傞壜擻惈傕掅偔側偄偲峫偊傜傟傞丅
堄恾揑偵GVLE傪婲偙偡偑丄摉慠儕僗僋偑戝偒偄丅
Toll條庴梕懱
帺慠柶塽偼丄儅僋儘僼傽乕僕丄庽忬嵶朎側偳偄傢備傞峈尨採帵嵶朎偵傛傝扴傢傟偰偄傞丅偙傟傜偺嵶朎偼丄堚揱巕嵞峔惉傪峴偊側偄偺偱丄旝惗暔傪摿堎揑偵擣幆偼偟側偄偲峫偊傜傟偰偄偨丅偟偐偟丄偙傟傜偺嵶朎傕丄奜棃旝惗暔傪擣幆偱偒傞僔僗僥儉傪桳偟偰偄傞偙偲偑柧傜偐偵側偭偰偒偨丅偙偺旝惗暔擣幆偵昁恵偺婡擻暘巕偑丄Toll條庴梕懱(Toll-like
receptor, TLR)偲屇偽傟傞堦孮偺枌僞儞僷僋偱偁傞丅
摦暔偺嵶朎昞柺偵偁傞庴梕懱偨傫傁偔幙偱丄庬乆偺昦尨懱傪姶抦偟偰帺慠柶塽傪嶌摦偝偣傞婡擻偑偁傞丅愐捙摦暔偱偼丄妉摼柶塽偑摥偔偨傔偵傕Toll條庴梕懱側偳傪夘偟偨帺慠柶塽偺嶌摦偑昁梫偱偁傞丅
Toll條庴梕懱偺柤慜偼丄僔儑僂僕儑僂僶僄偺Toll偲屇偽傟傞枌僞儞僷僋偵峔憿偑椶帡偟偰偄傞偙偲偵桼棃偡傞Toll條庴梕懱偼丄庬乆偺昦尨懱摿桳偺暘巕峔憿偺擣幆偵娭梌偡傞丅偙偺暘巕峔憿偼丄屄乆偺昦尨懱偵摿桳偲偄偆傢偗偱偼側偔丄堦孮偺旝惗暔偵嫟捠偵傒偲傔傜傟傞峔憿偱偁傞丅(昦尨懱惉暘傪僷僞乕儞擣幆:堎暔惉暘傪俋庬椶偵暘椶偟偰擣幆乯偦偟偰丄偙傟傜偺峔憿偼丄廻庡偱偁傞惗懱撪偵偼敪尰偝傟偰偄側偄丅偡側傢偪丄惗懱偵偼懚嵼偟側偄峔憿丄懠偐傜怤擖偟偰偒偨峔憿傪姶抦偡傞偺偑Toll條庴梕懱偱偁傞丅Toll條庴梕懱偺儕僈儞僪偼丄偄偢傟傕柶塽墳摎傪嫮偔妶惈壔偟丄傾僕儏僶儞僩偲偟偰婡擻偡傞丅嵟傕峀偔尋媶偝傟偰偄傞偺偼丄僌儔儉堿惈嬠偵嫟捠偟偰懚嵼偡傞儕億懡摐(lipoplysaccharide:
LPS)偱偁傞丅LPS偼丄嬠懱奜枌偺庡惉暘偱偁傝丄TLR4偵傛傝擣幆偝傟傞 丅
NKT嵶朎
丒峈尨庴梕懱乮V兛14/V兝8庴梕懱乯丗NKT嵶朎偼丄峈尨採帵嵶朎偺MHC條暘巕乮CD1d暘巕乯偵寢崌偟偨丄摐帀幙偱偁傞兛-僈儔僋僩僔儖僙儔儈僪傪峈尨偲偟偰擣幆偟偰妶惈壔偝傟丄IL-4偲IFN兞傪嶻惗丅NKT嵶朎偺峈尨庴梕懱偼兛兝嵔偐傜峔惉偝傟偰偄傞偑丄T嵶朎偺峈尨庴梕懱乮TCR乯偲堎側傝丄兛嵔偼丄懡條惈偺側偄1庬椶偺V兛14庴梕懱偱偁傞丅
丂丒NK嵶朎庴梕懱乮CD161乯丗NKT嵶朎偼丄昗揑嵶朎偺摐嵔傪擣幆偟偰寢崌偟丄昗揑嵶朎傪彎奞偡傞丅
丂丒NK嵶朎偲摨條偵丄梷惂庴梕懱乮MHC僋儔僗嘥暘巕庴梕懱乯傪桳偟偰偍傝丄MHC僋儔僗俬暘巕傪敪尰偟偨惓忢嵶朎偼忈奞偟側偄丅
NKT嵶朎偼丄NK嵶朎偲斾偟偰丄峈尨庴梕懱偺峔憿偑丄T嵶朎偵嬤偄揰偱丄恑壔偟偰偄傞偑丄僿儖僷乕T嵶朎偲斾傋偰丄僒僀僩僇僀儞嶻惗擻偑暘壔偟偰偍傜偢乮Th丄Tc偲傕偵妶惈壔乯丄尨巒揑偲尵偊傞丅